Faseranalytik nach Weender und van Soest
Bei Fasern handelt es sich um langgestreckte, feine Strukturen mit unterschiedlichem Ursprung. Sie sind zum Beispiel Grundlage vieler Alltagsgegenstände und unserer Nahrung. So basieren Textilien und Baustoffe sowie Lebens- und Futtermittel auf Fasern. Man unterscheidet zwischen Natur- und Chemiefasern.
Fasern im Allgemeinen
Chemie- oder Kunstfasern werden synthetisch hergestellt, häufig auf Basis von Erdöl. Zu den bekanntesten Kunstfasern zählen Polyester, Elasthan und Polyacryl. Naturfasern stammen dagegen von Pflanzen, Tieren oder Mineralien, sind also natürlichen Ursprungs. Unter den Naturfasern spielen Pflanzenfasern eine wesentliche Rolle. Sie bestehen aus pflanzlichem Festigungsgewebe und sind Teil der pflanzlichen Zellwand. Pflanzenfasern sind sowohl in Blättern und Stängeln als auch in Wurzeln und Früchten zu finden.
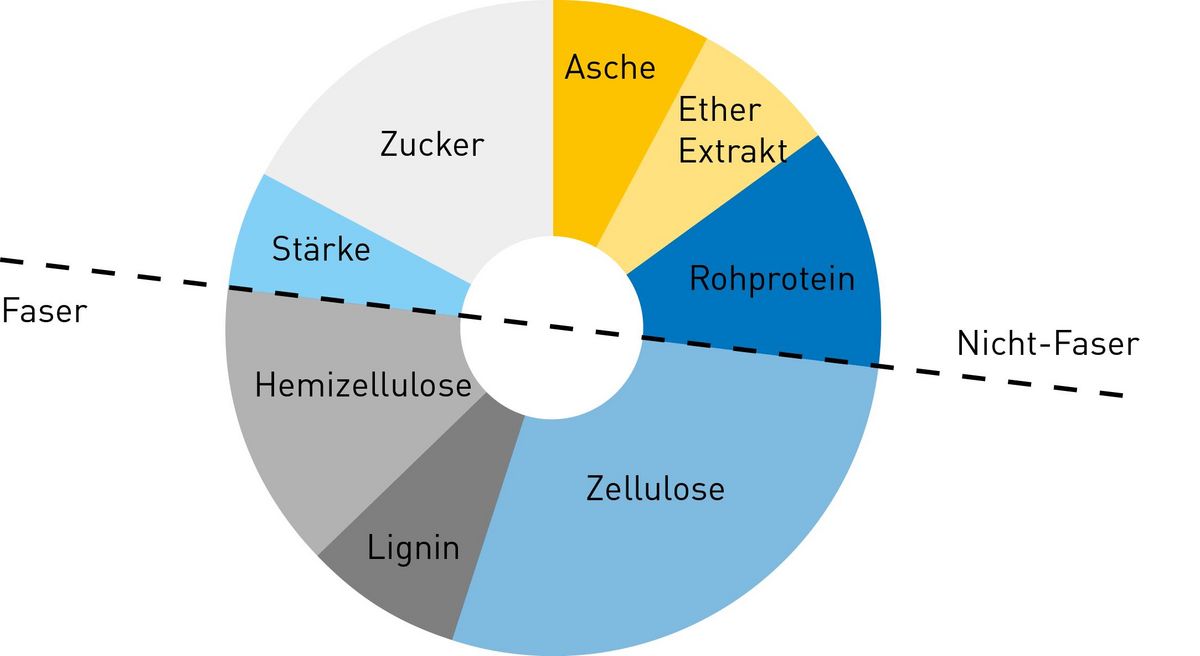
Pflanzenfasern bestehen größtenteils aus Zellulose, einem Polysaccharid, das aus einfachen Glucose-Molekülen aufgebaut ist. Die Zellulosefibrillen wiederum befinden sich in einer Matrix aus Pektin, Hemizellulose und Proteinen. Bei mehrjährigen Pflanzen ist in vielen Fällen zusätzlich das Biopolymer Lignin eingelagert. Lignin sorgt für eine Verholzung von Zellen.
Viele Futtermittel basieren auf pflanzlichen Fasern. Das gilt nicht nur für Grünfutter wie Gräser und Kräuter, sondern auch für Trockenfutter, das häufig in Form von Pellets verfüttert wird. Daher sind neben Rohprotein und Rohfett auch Rohfasern ein wesentlicher Bestandteil von Futtermitteln.
Rohfasern sind nur schwer oder gar nicht verdaulich, liefern dem Tier also keine zusätzliche Energie. Dennoch sind sie in bestimmten Mengen gesundheitsförderlich. Denn Rohfasern erhöhen die Darmtätigkeit und regen so die Verdauung an, wirken also ähnlich wie Ballaststoffe in Lebensmitteln. Bei der Herstellung von Futtermitteln gilt es daher eine gute Balance zwischen verdauungsfördernden Rohfasern und einer hohen Verträglichkeit sicherzustellen. Abhilfe für eine optimale Zusammensetzung schafft die Faseranalytik.
Historische Entwicklung der Weender Futtermittelanalyse
Bei der Analyse von Fasern besteht eine besondere Herausforderung. Denn Faserbestandteile sind in einer Probe fest gebunden. Sie müssen also aus dem Verbund herausgelöst und Nicht-Faser-Bestandteile wie Proteine und Pektine, entfernt werden. Die Weender-Methode begegnet dieser Herausforderung.
Die Weender-Analyse ist gut reproduzierbar, sodass schnell große Datenmengen zu allen Futtermittelkomponenten gewonnen werden können. Dennoch weist die Analyse auch Schwachstellen auf: So ist es zum Beispiel nicht möglich, die Kohlenhydrate innerhalb einer Probe spezifischer zu segmentieren. Dadurch können keine genauen Angaben über den Gehalt spezieller Nährstoffe wie Lignin, Hemizellulose oder Zellulose gemacht werden. Allein mit der Weender-Analyse lässt sich die Nutzbarkeit von Nährstoffen in Futtermitteln also nicht vollständig beurteilen.
Vor- und Nachteile der Weender-Analyse
| Vorteile | Nachteile |
| Reproduzierbarkeit | Keine Analyse spezieller Nährstoffe |
| Inhaltliche Konsistenz über langen Zeitraum | Keine exakte Beurteilung der Nährstoffzusammensetzung möglich |
| Große Datenmengen innerhalb von kurzer Zeit | Keine exakte Segmentierung von Kohlenhydraten |
Da die klassische Weender-Analyse verhältnismäßig also eher unspezifisch ist, wird sie heutzutage durch die Detergenzien-Methode zur Analyse von Futtermitteln nach van Soest ergänzt. Diese wurde in den 1960er Jahren von Peter van Soest im Landwirtschaftsministerium der Vereinigten Staaten entwickelt.
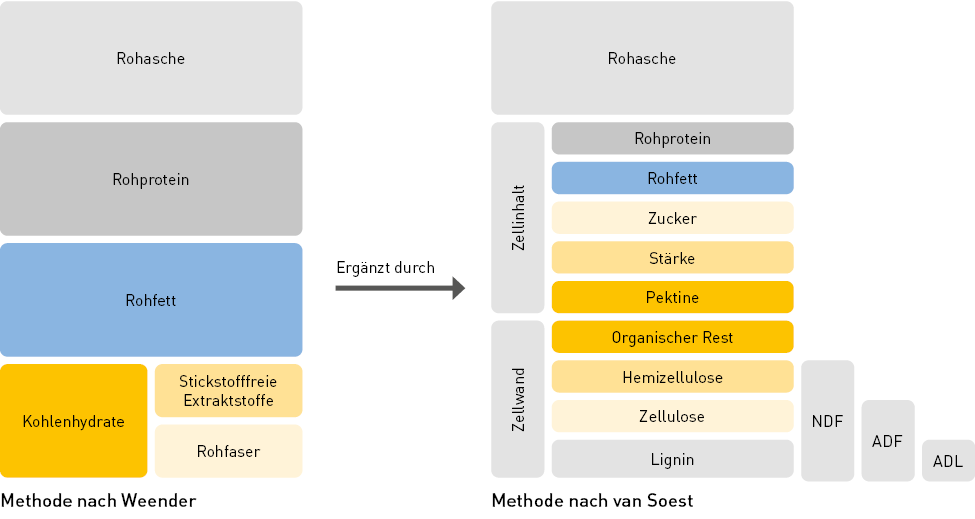
Die Bestimmung nach van Soest beruht auf dem Konzept der Detergenzienfaser-Analyse und unterteilt die Pflanzenzelle zunächst in Zellwände und Zellbestandteile. Die Zellwände bestehen aus den weniger löslichen Bestandteilen Hemizellulose, Zellulose und Lignin. Die größtenteils löslichen Zellbestandteile sind Rohprotein, Rohfett, Pektine, Stärke und Zucker.
Die Weender-Methode betrachtet davon die Komponenten Rohprotein und Rohfett separat. Allerdings gehören Pektine, Stärke und Zucker nach Weender zu den stickstofffreien Extraktstoffen, werden also nicht separat betrachtet. Van Soest nimmt zunächst eine Unterteilung in zwei Gruppen, die Zellwände und Zellbestandteile, vor. Die Bestandteile der Zellwand werden dann noch weiter analysiert, sodass die folgenden Detergenzienfasern bestimmt werden:
- Neutral-Detergenzienfasern (NDF): Auch “Neutral Detergent Fibre”, also die Faserbestandteile, die in einer neutralen Detergenzienlösung unlöslich sind.
- Säure-Detergenzienfasern (ADF): Auch “Acid Detergent Fibre”, also die Faserbestandteile, die in einer leicht sauren Detergenzienlösung unlöslich sind.
- Säure-Detergenzienlignin (ADL): Auch “Acid Detergent Lignin”, also der Lignin-Anteil der Probe, der selbst in konzentrierter Schwefelsäure unlöslich ist.
Analytischer Ablauf der Faserbestimmung
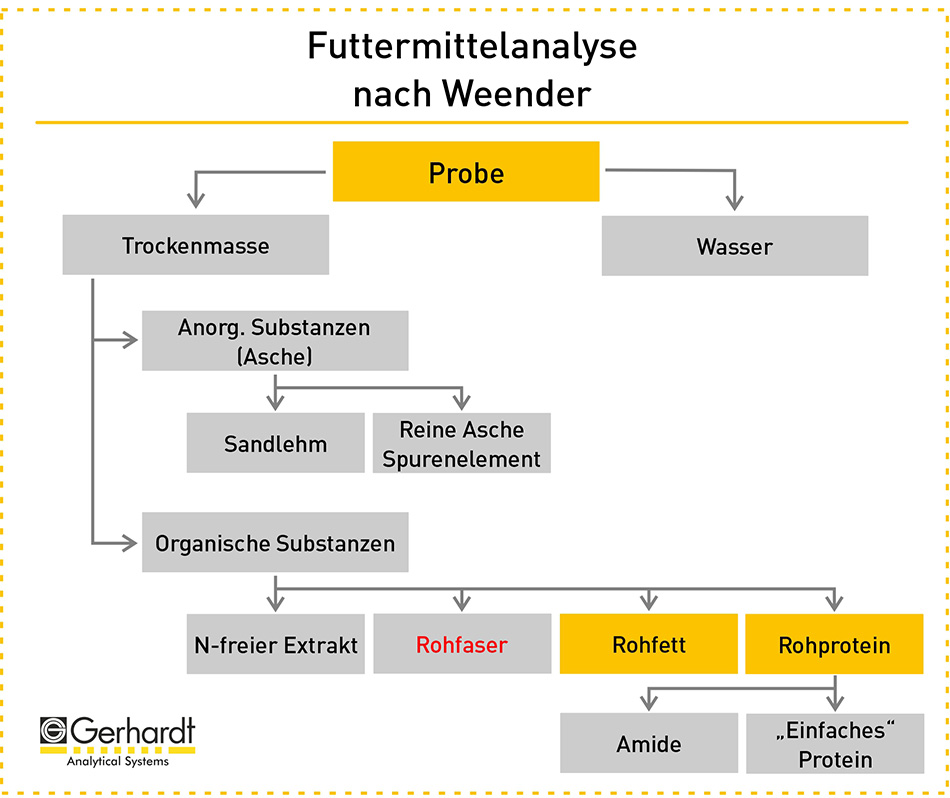
Bei der Weender-Analyse werden der Rohasche-, Rohprotein-, Rohfett- und Rohfaseranteil einer Futtermittelprobe bestimmt. Daraus wird wiederum der stickstofffreie Extrakt berechnet. Von diesen fünf Komponenten ist der Rohfaseranteil der entscheidende Parameter für die Faseranalytik.
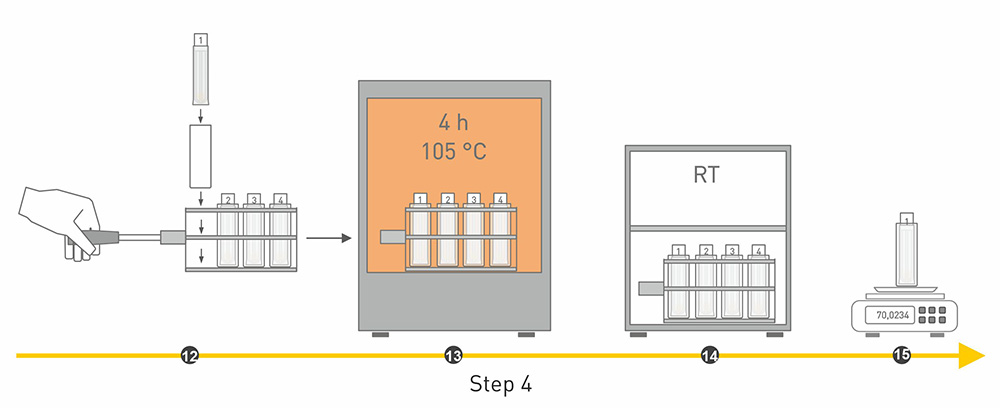
Bei der Ermittlung des Rohfaseranteils, besteht der erste Analyseschritt darin, die Futtermittelprobe zu trocknen. Der Probe wird also bei 103-105°C zunächst das Wasser entzogen und zurück bleibt die Trockenmasse. Diese setzt sich aus anorganischen und organischen Substanzen zusammen. Letztere sind Rohprotein, Rohfett, Rohfaser und stickstofffreie Extrakte.
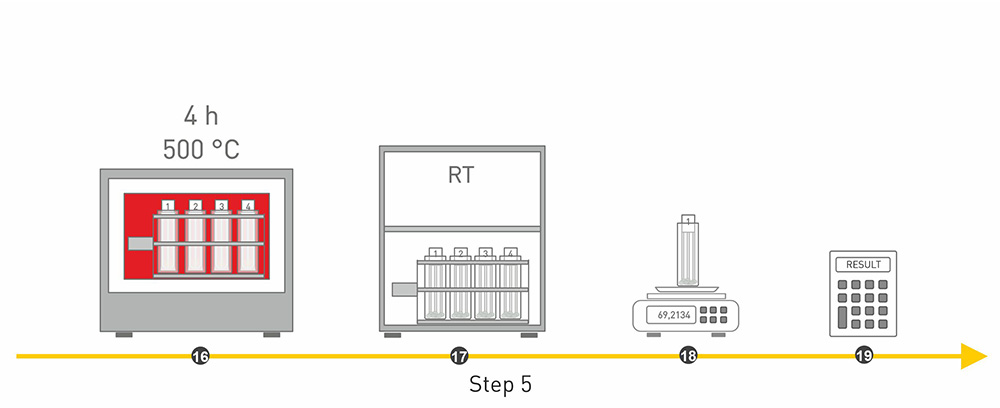
Der zweite Schritt besteht darin die Probe zu entfetten. Dafür wird das Fett mit einem Lösungsmittel extrahiert. Im dritten Schritt werden die Komponenten Stärke, Zucker und Rohprotein nach und nach durch einen Kochprozess mit Laugen und Säuren herausgewaschen. Bei dem vierten Schritt wird die restliche Probe zunächst nochmal getrocknet und anschließend in einem Muffelofen bei 500°C verascht. Anschließend bleiben nur noch die anorganischen Stoffe in Form von Asche übrig. Im fünften Schritt wird mittels Differenzwägung quantitativ der Rohfasergehalt bestimmt.
Die Bestimmung nach van Soest spezifiziert die Faseranalytik, indem neben dem Rohfasergehalt noch der NDF-, ADF- und ADL-Gehalt einer Probe ermittelt werden.
Der analytische Ablauf ist ähnlich zur Bestimmung des Rohfasergehaltes, unterscheidet sich jedoch in der Zusammensetzung der Detergenzienlösungen und deren pH-Wert.
Für die NDF-Bestimmung wird die Probe nach der Probenvorbereitung, Trocknung und Entfettung zunächst für ca. 60 Minuten mit einer Neutral-Detergenzlösung (NDS) behandelt und mit einer hitzestabilen Amylase gewaschen. Wie der Name schon sagt, handelt sich hierbei um eine neutrale Detergenzienlösung. Dadurch werden Zucker, Stärke und Pektine aufgelöst und der Anteil an NDF kann ermittelt werden. Die verbleibenden Rückstände bestehen dann nur noch aus den un- oder schwer-verdaulichen Zellwand-Bestandteilen Hemizellulose, Zellulose und Lignin.
Bei der ADF-Bestimmung wird die Probe nach der Probenvorbereitung, Trocknung und Entfettung ebenfalls für ca. 60 Minuten mit einer Detergenzlösung behandelt. Bei dieser Analyse wird jedoch eine Säure-Detergenzlösung (ADS) verwendet. Dadurch wird die Hemizellulose aufgelöst und es bleiben nur noch Lignin und Zellulose übrig. Im Anschluss kann der Anteil an Säure-Detergenzienfasern bestimmt werden.
Bei der ADL-Bestimmung ist es so, dass die Probe zunächst wie eine ADF-Probe behandelt wird. Das heißt, nach der Probenvorbereitung, Trocknung und Entfettung wird die Probe erstmal für ca. 60 Minuten mit einer Säure-Detergenzlösung (ADS) behandelt. Im Anschluss daran wird der Rückstand aus Zellulose und Lignin in einem letzten Schritt mit konzentrierter Schwefelsäure behandelt. Dadurch löst sich die Zellulose auf und zurück bleibt Lignin. So wird dann der Gehalt an Säure-Detergenzienlignin (ADL) bestimmt.
Automatisierung der Analytik
Nun bestehen die analytischen Abläufe nach Weender und van Soest aus vielen manuellen Schritten. Dementsprechend sind die Prozesse für das Laborpersonal sehr zeitaufwendig. Sie können aber durch den Einsatz von bestimmten Technologien und Analysesystemen vereinfacht und automatisiert werden, sodass wertvolle Arbeitszeit eingespart werden kann.
So bietet C. Gerhardt verschiedene Möglichkeiten der Prozessoptimierung in der Faseranalytik.
Die Probenvorbereitung lässt sich beispielsweise durch ein Entfettungsmodul vereinfachen. Das Entfetten der Probe vor der Analyse ist wichtig, da es ein Überschäumen der Probe während des Kochprozesses vermeidet und dem Verstopfen des Filters vorbeugt. Mithilfe des Moduls können sechs Proben gleichzeitig entfettet werden. Dafür wird ein handlicher Einsatz verwendet, der eine gleichmäßige Benetzung der Proben mit Lösungsmittel ermöglicht. Im Gegensatz zur klassischen Glas-Fritten-Methode, bei der immer wieder Lösungsmittel nachgeschüttet werden muss, spart das Entfettungsmodul also Lösungsmittel ein.


Zudem hat C. Gerhardt den sogenannten FibreBag entwickelt: Dabei handelt es sich um einen speziellen Filterbeutel, in dem die Probe eingewogen wird. Diese Technologie vereinfacht das Lösen und Filtrieren der Probenbestandteile erheblich, da sie
- die Filtration durch eine definierte Maschenweite standardisiert,
- eine große Oberfläche für einen effektiven Detergenziendurchlass bietet,
- rückstandsfrei im Muffelofen verbrannt werden kann und
- eine angepasste Porengröße für die ADF/NDF Bestimmung hat.
Die oben genannten Punkte sorgen für bessere und zuverlässigere Analysenergebnisse im Vergleich zur klassischen Filtermethode über Fritten und Filterbetten. Denn Glas-Filter bieten zwar den Vorteil der Wiederverwendbarkeit. Sie müssen dafür im Vorfeld allerdings aufwendig ausgebrannt, mit Celite gepackt und vorbereitet werden. Zudem ist die Lebenszeit einer handelsüblichen Fritte auf Grund der harschen Bedingungen des Prozesses mit Säuren, Laugen und Temperaturen bis zu 550°C stark begrenzt. Aus diesem Grund hat sich die Porengröße üblicherweise bereits nach 10-20 Anwendungen so stark verändert, dass die Fritte ausgetauscht werden muss.
Mit der FibreBag-Technologie entfallen die Vor- und Nachbereitungsschritte vollständig. Zudem wird die Filtration standardisiert, da die Porengröße bei jeder Analyse gleich ist. Dadurch werden mit der FibreBag-Technologie vergleichbare Ergebnisse wie bei der klassischen Glasfilter Methode nach Weender und van Soest erzielt. Durch die Standardisierung der Filtrationbedingungen kann sogar eine bessere Standardabweichung erreicht werden.
Faseranalyse mit FIBRETHERM
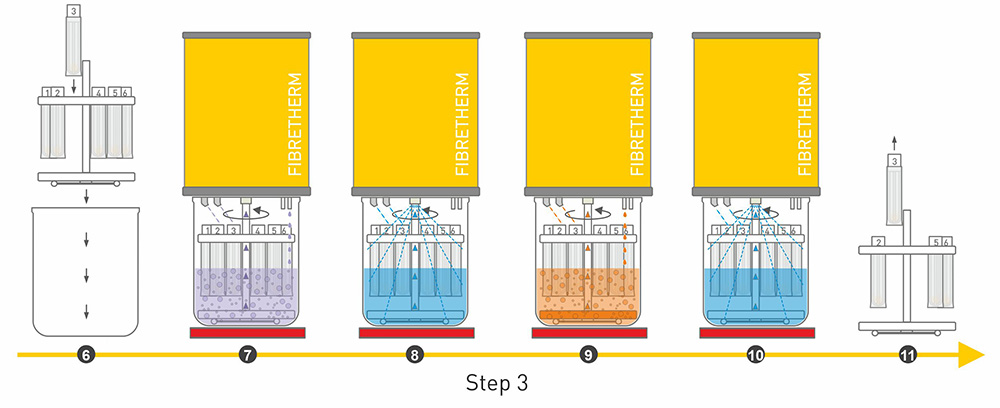
Für den Analyseprozess an sich bietet C. Gerhardt das vollautomatische FIBRETHERM Analysesystem an. FIBRETHERM erledigt die aufwendigen Koch-, Wasch-, Filtrations- und Spülprozesse zur Extraktion der Faseranteile im geschlossenen System für gleichzeitig 12 Proben. Die analytische Methode kann vorher einprogrammiert und anschließend ausgewählt werden, sodass sie auf die verschiedenen Probenparameter angepasst ist: Rohfaser, NDF und ADF.
Bei der ADL-Analyse kann FIBRETHERM zur Vorbereitung der Probe eingesetzt werden, damit die ADF-Analyse durchgeführt werden kann. Die Behandlung der Probe mit konzentrierter Schwefelsäure muss jedoch manuell durchgeführt werden. Dafür kann wiederum das Entfettungsmodul genutzt werden. Denn es ist Entfettungsmodul und das manuelle FibreBag-System in einem. Dieses kann auch für die anderen Parameter der Faseranalyse genutzt werden. Beispielsweise für Labore mit einem kleineren Probenaufkommen. Auch wenn die Wasch- und Kochprozesse dann manuell durchgeführt werden, optimieren das Entfettungsmodul und die FibreBag-Technologie den Prozess dennoch.
Entsprechende Applikationsdokumente sowohl für das manuelle FibreBag-System, als auch für FIBRETHERM, stehen dem Anwender zur ersten Orientierung zur Verfügung.